Топлотата на образованието е какво?
Нека да поговорим за това какво представлява топлинатаобразование, както и дефиниране на тези условия, които се наричат стандартни. За да разберем този въпрос, ще изясним разликите между прости и сложни вещества. За да се консолидира понятието "топлина на образуване", ще разгледаме специфични химически уравнения.

Стандартната енталпия на образуването на вещества
В реакцията между въглерод и газообразенводородът генерира 76 kJ енергия. В този случай тази цифра е топлинният ефект на химическата реакция. Но това е и топлината на образуване на метановата молекула от прости вещества. "Защо?" - питаш. Това се обяснява с факта, че първоначалните компоненти са въглерод и водород. 76 kJ / mol ще бъде енергията, която химиците наричат "топлина на образуване".

Таблици с данни
В термохимията има многобройни таблици, в които са посочени оборотите на образуването на различни химикали от прости вещества. Например топлината на образуване на вещество, чиято формула СО2, в газообразно състояние има индекс от 393.5 kJ / mol.
Практическо значение
Защо се нуждаем от тези ценности? Топлината на образуване е количество, което се използва при изчисляване на топлинния ефект на всеки химичен процес. За да се извършат такива изчисления, ще се изисква прилагането на Закона за термохимията.

термохимия
Това е основният закон, който обясняваенергийни процеси, наблюдавани по време на процеса на химична реакция. По време на взаимодействието се наблюдават качествени трансформации в реагиращата система. Някои вещества изчезват, вместо това се появяват нови компоненти. Този процес е съпроводен от промяна във вътрешната енергийна система, изразена под формата на работа или топлина. Работата, свързана с разширяването, за химическите трансформации, има минимална стойност. Топлината, освободена, когато един компонент се преобразува в друго вещество, може да бъде голямо количество.
Ако разгледаме различни трансформации,За почти всички се наблюдава абсорбция или отделяне на определено количество топлина. За да се обяснят съществуващите феномени, беше създадена специална секция - термохимия.
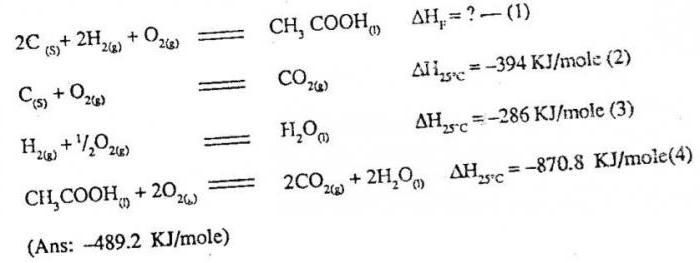
Хесенският закон
Благодарение на първия закон на термодинамиката,възможно да се извърши изчислението на термичен ефект в зависимост от условията на химическата реакция. Въз основа изчисления на главната термохимия закона, а именно правото на Хес. Нека формулировка си: термична химическа трансформация ефект, свързани с естеството, първоначалното и крайното състояние на материала, не е свързана с пътя на взаимодействие.
Какво произтича от тази формулировка? В случай на получаване на определен продукт не е необходимо да се използва само един вариант на взаимодействие, възможно е реакцията да се извърши по различни начини. Във всеки случай, без значение как ще получите желаното вещество, топлинният ефект от процеса ще бъде непроменен. За да го определим, трябва да обобщим топлинните ефекти на всички междинни трансформации. Благодарение на закона на Хес стана възможно да се правят изчисления на топлинните ефекти, които не могат да се правят в калориметър. Например, топлината на образуване на въглероден монооксид вещество се изчислява количествено според закона на Хес, но с обикновени експерименти няма да можете да го определите. Ето защо специалните термохимични таблици са много важни, при които числови стойности за различни вещества, определени при стандартни условия

Важни точки в изчисленията
Като се има предвид, че топлината на образованието етоплинният ефект на реакцията, агрегатното състояние на въпросното вещество е от особено значение. Например, когато се правят измервания, графитът се счита за стандартното състояние на въглерод, а не диамант. Също така да се вземе под внимание налягането и температурата, т.е. условията, при които първоначално съществуваха реагиращите компоненти. Тези физични количества могат да окажат значително влияние върху взаимодействието, да увеличат или намалят количеството енергия. За извършване на основни изчисления е обичайно да се използват специфични показатели за налягане и температура в термохимията.
Стандартни условия
Тъй като топлината на образуване на вещество еопределяне на енергия ефект е при стандартни условия, ги разграничава отделно. Температура избран за изчисляване на 298К (25 градуса по Целзий) налягане - 1 атмосфера. Освен това, един важен момент, който заслужава внимание, е фактът, че топлината на образуване на някакви прости вещества е нула. Това е логично, защото простите вещества не се образуват, което означава, че няма потребление на енергия за настъпването им.
Елементи на термохимията
Този раздел на съвременната химия има специаленстойност, тъй като тук се извършват важни изчисления, те получават конкретни резултати, използвани в топлинната енергетика. В термохимията има много понятия и термини, които е важно да се работи, за да се получат желаните резултати. Енталпията (ΔХ) показва, че химическото взаимодействие е възникнало в затворена система, няма ефект върху реакцията от други реагенти, налягането е постоянно. Това уточнение ни позволява да говорим за точността на изчисленията.
В зависимост от реакциятапомислете, че величината и знакът на получения топлинен ефект могат да варират значително. Така, за всички трансформации, включващи разпадането на едно сложно вещество в няколко прости компонента, се приема абсорбция на топлина. Реакциите на комбиниране на множество изходни материали в един, по-сложен продукт се придружават от освобождаването на значително количество енергия.

заключение
При решаване на всеки термохимичен проблемприлагат един и същ алгоритъм на действията. Първо, според таблицата стойността на топлината на образуване се определя за всеки първоначален компонент, както и за реакционните продукти, без да се забравя агрегатното състояние. След това, въоръжени с хесенския закон, представляват уравнението за определяне на желаното количество.
Особено внимание трябва да се обърне на счетоводствотоСтереохимичните коефициенти, налични преди първоначалните или крайните вещества в дадено уравнение. Ако в реакцията има прости вещества, тогава стандартната им топлина на образуване е нула, т.е. такива компоненти не влияят върху получения резултат при изчисленията. Ще се опитаме да използваме получената информация за конкретна реакция. Ако вземем като пример процеса на образуване от железен оксид (Fe3+) от чист метал чрез взаимодействие с графит, тогава в ръководството могат да се намерят стойностите на стандартната топлина на образуване. За железен оксид (Fe3+) ще бъде -822,1 kJ / mol, за графит(проста материя) това е нула. В резултат на реакцията се образува въглероден окис (СО), за който тази стойност е 110.5 kJ / mol, а за освободеното желязо образуването на топлина съответства на нула. Записването на стандартната топлина на образуване на дадено химическо взаимодействие се характеризира, както следва:
? Нза298 = 3 х (-110.5) - (-822.1) = -331.5 + 822.1 = 490.6 kJ.
Анализирайки числото на Хесв резултат може да се направи логично заключение, че този процес е ендотермична трансформация, т.е. тя включва изразходването на енергия върху реакцията на редукция на желязото от нейния тривалентен оксид.






